Essais cliniques comparatifs pour le traitement antirétroviral de 1ère ligne depuis 2006
Comparaison des inhibiteurs d’intégrase vs IP
Etude ACTG A5257 : (ATV/r vs DRV/r vs RAL) �+ TDF/FTC
Original article : Ann Intern Med. 2014 Oct 7;161(7):461-71 - JL Lennox, Clin Infect Dis. 2015 Jun 15;60(12):1842-51 - I Ofotokun, J Infect Dis. 2015 Oct 15;212(8):1241-9 - TT Brown, CROI 2015, Abs. 140 - Mc Comsey GA & Clin Infect Dis. 2015 Aug 15;61(4):651-60 - T Kelesidis
Dernière mise à jour :
10/09/2015
Pr François Raffi
Centre Hospitalier Universitaire
Nantes, France
- ATV/r, RAL et DRV/r étaient équivalents en terme d'efficacité virologique, lorsque administrés avec TDF/FTC
- ATV/r + TDF/FTC était moins bien toléré que DRV/r + TDF/FTC ou RAL
+ TDF/FTC
- Dans l'évaluation composite de l'efficacité virologique et de la tolérance
- RAL + TDF/FTC était supérieur aux 2 schémas avec IP
- DRV/r + TDF/FTC était supérieur à ATV/r + TDF/FTC
- Les résultats de tolérance étaient principalement dus aux ictères sous
ATV/r et à la toxicité gastro-intestinale pour les 2 IP/r
- ATV/r était moins bien toléré que DRV/r et RAL dans tous les sous-groupes
- Le bénéfice de tolérabilité de RAL versus DRV/r était plus important chez les femmes
- Limites : étude en ouvert, switch permis vers un autre bras pour problème de tolérance ou de toxicité
- En considérant à la fois la réponse virologique et la tolérance, RAL + TDF/FTC était globalement supérieur aux 2 schémas avec IP, et le DRV/r était supérieur à ATV/r. Un avantage des IP/r par rapport à RAL est le risque réduit d'émergence de résistance en cas d'échec virologique
Schéma

*
Stratifiée sur ARN VIH (< ou ≥ 100 000 c/ml) à la pré-inclusion, participation à la sous-étude cardiovasculaire,
et le score de risque Framingham à 10 ans
Objectif
- Evaluer l'équivalence des 3 schémas, en terme d'efficacité virologique et de tolérance sur 96 semaines, en analyse en intention de traiter. Equivalence définie par un IC 97,5 % bilatéral de la différence 2 à 2 de l'incidence cumulée de chaque critère de jugement individuel ou composite compris entre – 10 % et 10 %, avec une puissance de 90 %.
En cas d'équivalence non démontrée, la supériorité était définie par l'exclusion de 0 de l'IC 97,5 %
Critères de jugement
- Echec virologique : ARN VIH-1 confirmé > 1 000 c/ml à ou après S16,
ou > 200 c/ml à ou après S24
- Echec de tolérance : délai entre la randomisation et l'arrêt du traitement de la randomisation pour intolérance (substitution de TDF ou FTC non considéré comme échec)
- Critère composite : échec virologique ou de tolérance, survenant en premier
- ARN VIH-1 < 200 c/ml en ITT-TLOVR
- ARN VIH-1 < 50 c/ml à S96 en ITT, snapshot
- Analyse de sensibilité : sous traitement (échec virologique considérant la modification/arrêt de traitement comme un échec)
- Critère secondaire de toxicité : délai entre l'initiation du traitement et la survenue du premier signe ou symptôme de grade 2, 3, ou 4 (grade 3 ou 4 si après S48) ou d'une anomalie biologique de grade 3 ou 4, alors que le patient est sous traitement randomisé (sous traitement)
- Analyse de sensibilité pré-spécifiée excluant hyperbilirubinémie et élévation des CK
- Analyse de sensibilité incluant tous les événements indésirables quelque soit le traitement en cours (analyse en ITT)
Caractéristiques des patients à l'inclusion et devenir

Incidence cumulée d'échec virologique (critère principal)
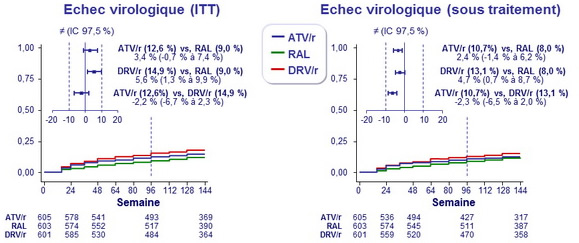
Equivalence des 3 schémas
Incidence cumulée d'échec de tolérance (critère principal)

- RAL est équivalent à DRV/r
- RAL est supérieur à ATV/r
- DRV/r est supérieur à ATV/r
Le bénéfice en terme de tolérance est plus marqué pour
- RAL vs ATV/r chez les patients avec ARN VIH < 100 000 c/ml à l'inclusion
- RAL vs DRV/r chez les femmes
Arrêt du traitement antirétroviral de la randomisation pour toxicité

Incidence cumulée de l'échec virologique ou de tolérance
(critère composite d'échec prévu au protocole)

- ATV/r est inférieur à DRV/r et à RAL
- DRV/r est inférieur à RAL
ARN VIH ≤ 50 c/ml,
indépendamment d'un changement
de traitement
(analyse en ITT)

ARN VIH ≤ 50 c/ml,
sous traitement de la randomisation
(analyse en ITT, snapshot)

Analyse génotypique de la résistance à l'échec virologique

Les patients n'étaient pas obligatoirement sous leur traitement initial (randomisation) à l'échec virologique
Evénements indésirables de grade ≥ 2 survenant chez ≥ 5 %
des patients dans 1 des groupes

Autres données de tolérance

* vs RAL
Modification moyenne (IC 95 %) des lipides à jeun, mg/dl

Pourcentage moyen de modification de la densité minérale osseuse à S96

Effet des CD4 et de la charge virale à l'inclusion sur la perte osseuse
- Ajustement sur âge, sexe, race/ethnicité, ARN VIH à l'inclusion et IMC : pas d'association entre CD4 plus bas et perte osseuse vertébrale ou de hanche
- Ajustement multivarié : ARN VIH plus élevé à l'inclusion associé à perte osseuse aux 2 sites (rachis, -1,53 % [IC 95 % : -2,28 % à -0,77 %] pour chaque log 10 c/ml d'augmentation [p < 0,001]; hanche totale, −0,82% [IC 95 % : -1,51 % à − 0,14 %] pour chaque log 10 c/ml d'augmentation [p = 0,02]
Analyses multivariées de la perte de densité minérale osseuse à S96
- Facteurs à l'inclusion associés avec la perte de DMO de hanche totale
- Concentrations plus élevées à l'inclusion de CRPus , IL6, et CD14s
- Facteurs à l'inclusion associés avec la perte de DMO du rachis lombaire
- Marqueurs de sénéscence et de déperdition des cellules T CD4+ (CD4+CD28−CD57+PD1+)
- Marqueurs d'activation des cellules T CD4+ (CD4+CD38+HLA-DR+)
Pourcentage moyen (97,5 %) de modification de la composition corporelle à S96, ITT :
graisse périphérique, graisse tronculaire, et masse maigre (DXA scan),
graisse abdominale viscérale et sous-cutanée (scan abdomen)

p (ATV/r vs DRV/r, IP/r vs RAL) tous non significatifs
Augmentation plus importante du tour de taille avec RAL vs DRV/r à S48 et S96 (p ≤ 0,023),
mais pas avec RAL vs ATV/r (p ≥ 0,07)
Effet de la charge virale à l'inclusion sur les
modifications de graisse dans les 3 groupes à S96

- Modifications de la graisse centrale corrélées aux modifications de la graisse périphérique (r = 0,67 ; p < 0,001)
- Pas de modification du rapport GAV/ Graisse totale entre les différents bras de traitement
- Gain plus important de GAV associé à :
- Taux plus bas de leptine à l'inclusion
- Taux plus élevé d' adiponectine à l'inclusion
- Taux d'ARN VIH
- Gain plus important de GAS associé aux mêmes facteurs, ainsi que en plus avec
un taux plus élevé d' IL-6
- Gain plus important de masse maigre
associé à :
- Taux plus élevé d'ARN VIH, d' IL-6 et de D-dimères, et taux plus bas de CD4 à l'inclusion
Modifications des marqueurs d'inflammation et d' activation immune
- Sous-étude A5260S (328 patients) : 234 inclus (ARN VIH < 50 c/ml à S24) : 68 sous ATV/r, 84 sous DRV/r et 82 sous RAL
- Marqueurs plasmatiques d'inflammation et de la coagulation : CRPus , IL-6, GlycA , D-dimères, CD14s, CD163s, et IL-2rs
- Marqueurs cellulaires : % sous populations lymphocytaires T CD38+DR+ et CD14+CD16+ et % sous populations monocytaires CD14( dim )CD16+
- Les modifications des biomarqueurs étaient différentes selon les groupes
au cours des 96 semaines de suivi :
- CRPus diminuait avec ATV/r et RAL
- IL-6 diminuait seulement avec RAL
- GLycA diminuait dans les 3 groupes
- D-dimères diminuaient avec ATV/r et DRV/r et étaient inchangés avec RAL
- Marqueurs d'activation cellulaire T et CD163s (mais pas CD14s et CD14+CD16+) diminuaient dans les 3 groupes
- Conclusion : pas d'évidence que la réduction de l'inflammation et de l'activation immune après initiation du traitement ARV différait entre RAL
et schémas avec IP
 Retour au sommaire Retour au sommaire
|



