Sax PE. Lancet 2015; 385:2606-15 ; Wohl D. J Acquir Immune Defic Syndr 2016; 72:58-64 ; Arribas JR. J Acquir Immune Defic Syndr. 2017 ;75:211-18
Type of ARV Trial
Estudios comparativos para TARV de primera línea desde 2006
» Combinaciones de INTR
» FTC/TDF vs FTC/TAF o E/C/F/TDF vs E/C/F/TAF
Estudios comparativos para TARV de primera línea desde 2006
» Combinaciones de INTR
» FTC/TDF vs FTC/TAF o E/C/F/TDF vs E/C/F/TAF
Drugs
E/C/F/TAF, E/C/F/TDF, FTC/TAF, FTC/TDF, TAF, TDF, FTC
E/C/F/TAF, E/C/F/TDF, FTC/TAF, FTC/TDF, TAF, TDF, FTC
- Resumen de resultados a semana 48
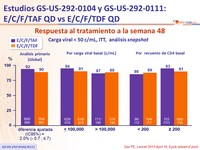
- E/C/F/TAF QD es virológicamente no inferior a E/C/F/TDF QD
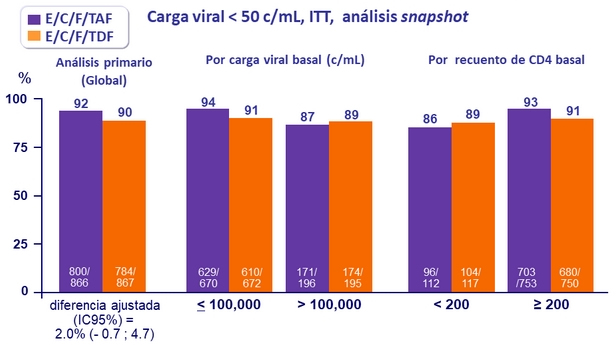
- 92% de los pacientes tratados con E/C/F/TAF alcanzaron supresión virológica a semana 48
- Altas y similares tasas de respuesta, independientemente de la carga viral basal, recuento de CD4, edad, sexo, raza
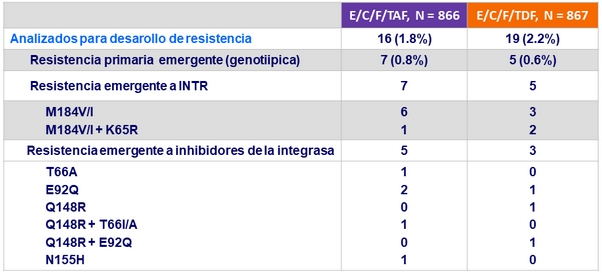
- Bajas tasas de fallo virológico, con resistencia emergente < 1% en ambas ramas
- Aumento de CD4 desde el basal significativamente mayor con E/C/F/TAF
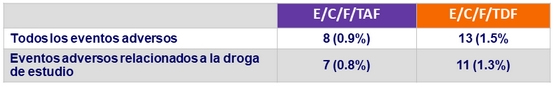
- Discontinuación por eventos adversos : 0.9 % vs 1.5 %
- Discontinuación debidas a eventos renales: 0 vs 4
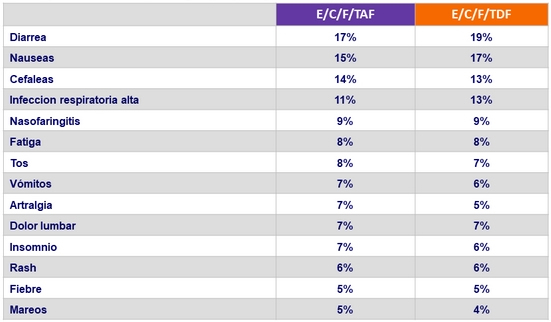
- Eventos adversos reportados con frecuencia similar en ambas ramas
- Sin casos de tubulopatia proximal
- Comparado con E/C/F/TDF, E/C/F/TAF demostró:
- Significativamente menores caídas en eGFR
- Significativamente menos proteinuria, albuminuria, y proteinuria tubular
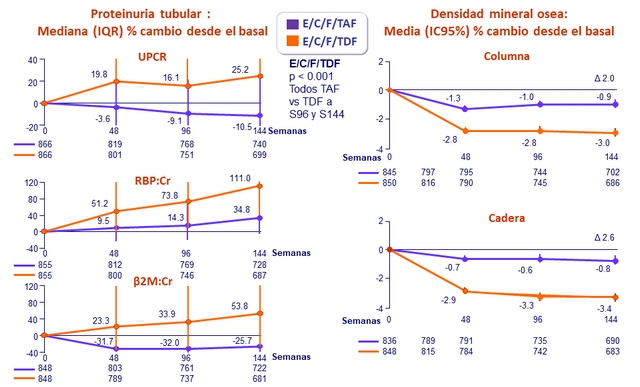
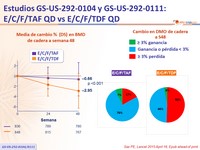
- Significativamente menor impacto en BMD de columna y cadera
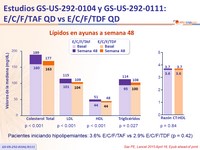
- Mayor incremento en lípidos de ayuno
Diseño
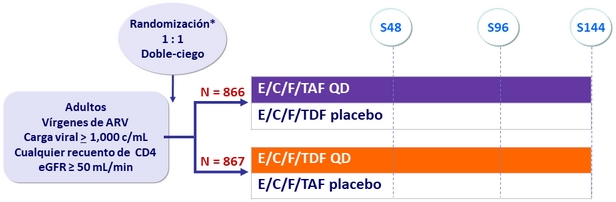
*
Randomización estratificada por carga viral ( ≤ o > 100,000 c/ mL ), recuento de CD4 al screening,
y región geográfica
Objetivos
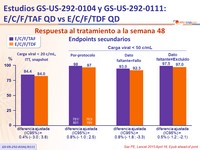
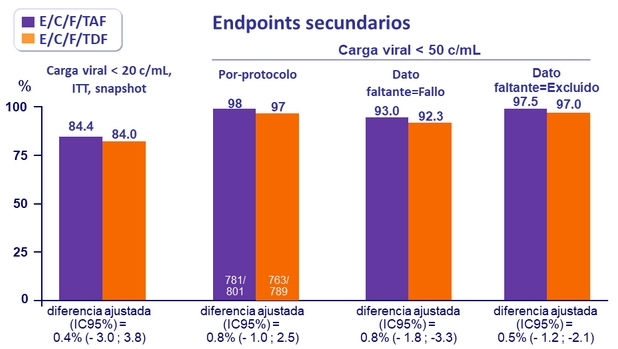
- No inferioridad de E/C/F/TAF a S48: % Carga viral < 50 c/ mL por intención de tratar, análisis snapshot (margen inferior del IC 95% para la diferencia = -12%)
- Seguridad: creatinina sérica, proteinuria, MMO* de cadera y columna
* MMO: Masa Mineral Ósea
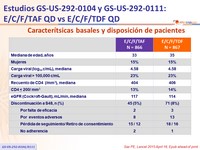
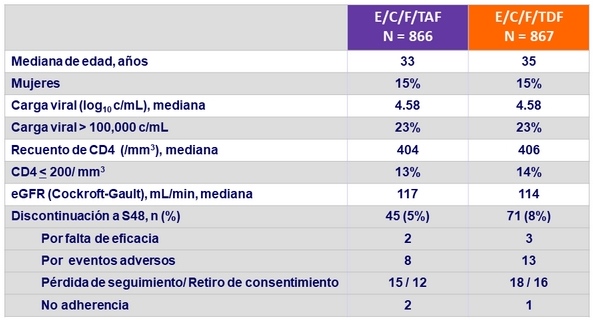
Características basales y disposición de pacientes
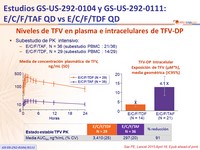
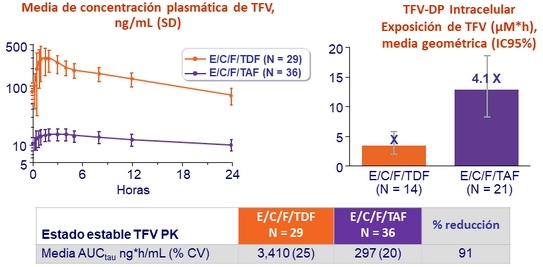
Niveles de TFV en plasma e intracelulares de TFV-DP
- Subestudio de PK i ntensivo :
- E/C/F/TAF, N = 36 ( s ubestudio PBMC : 21/36)
- E/C/F/TDF, N = 29 ( s ubestudio PBMC : 14/29)
Respuesta al tratamiento a la semana 48
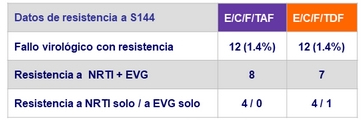
Criterios para las pruebas de Resistencia
- 2 cargas virales consecutivas > 50 c/mL (con la segunda ≥ 400 c/mL) después de alcanzar < 50 c/mL, o carga viral > 400 c/ mL a S48 o ultima visita del estudio
Resistencia a semana 48
Eventos adversos (todos los grados) ocurriendo en ≥ 5% de los pacientes en cada grupo (S48)
Eventos adversos determinantes de discontinuación de la droga de estudio
Muerte

Anomalías de laboratorio grado 3 o 4 en ≥ 1% de pacientes en cada grupo (S48)

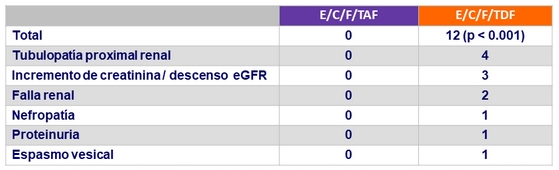
Discontinuación por evento renal
- E/C/F/TAF = 0
- E/C/F/TDF = 4: fallo renal = 2, disminución del filtrado glomerular GFR = 1, nefropatía = 1
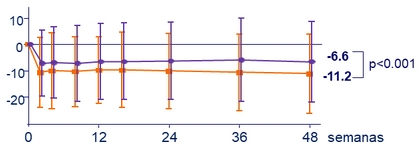
Media (DS) de cambio en eGFR ( Cockcroft-Gault ), mL /min, desde el basal
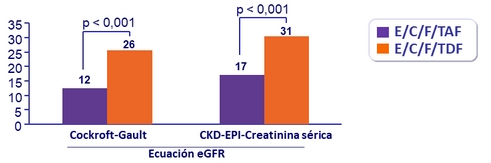
Pacientes con ≥ 25% reducción en el filtrado glomerular
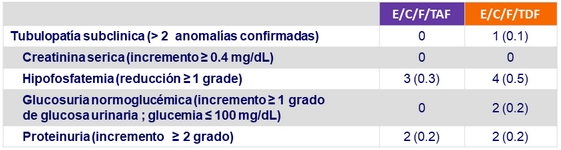
Anomalías renales de laboratorio a semana 48, n (%)
Cambios en la relación cuantitativa proteinuria/creatininuria a semana 48
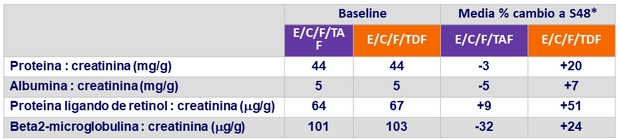
* p < 0.001
para todos
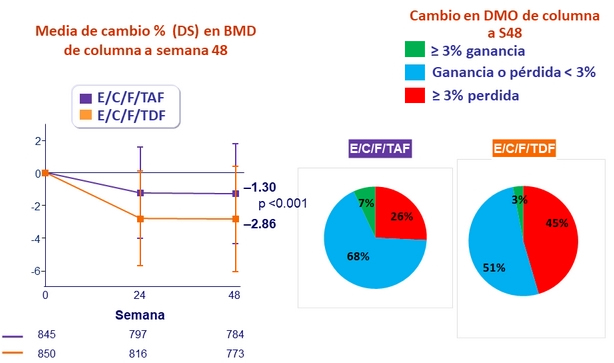
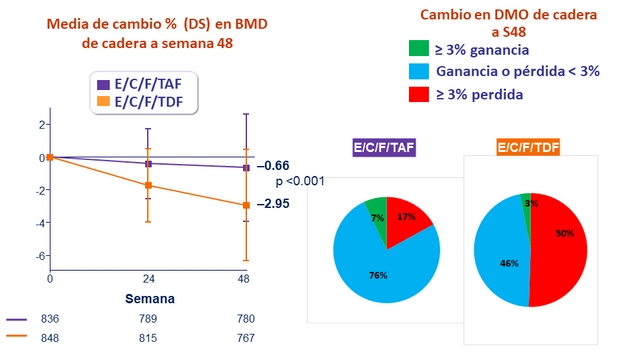
Lípidos en ayunas a semana 48
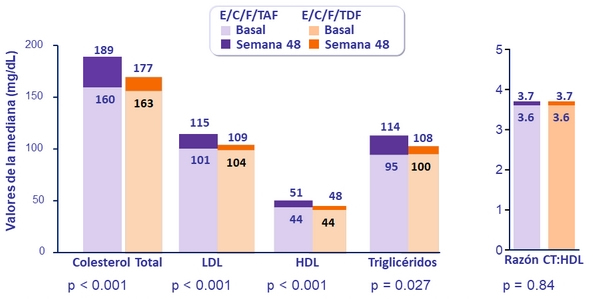
Pacientes iniciando hipolipemiantes : 3.6% E/C/F/TAF vs 2.9% E/C/F/TDF (p = 0.42)
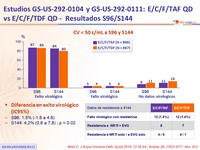
CV < 50 c/mL a S96 y S144
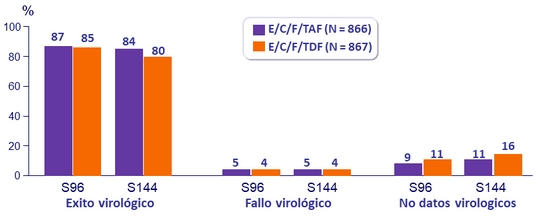
Diferencia en exito virológico (IC95%)
- S96: 1.5% (-1.8 a 4.8)
- S144: 4.2% (0,6 a 7,8) ; p = 0.02
Eventos renales que llevaron a discontinuación del tratamiento a S144
Eventos adversos que llevaron a discontinuación de tratamiento a S144
- 1.3% E/C/F/TAF vs 3.3% E/C/F/TDF (p = 0.01)
Eventos adversos grado 3-4
- No se observaron diferencias entre ambos grupos a S144 excepto por
- Incremento de LDL-colesterol: 11.0% E/C/F/TAF vs 4.8% E/C/F/TDF
- Incremento de c olesterol total: 4.7% vs 2.8%
- Incremento de lipasa : 5.0% vs 8.0%
- Incremento de amilasa : 2.6% vs 5.0%